LinDoの取り組み
シード・インキュベータ「株式会社LinDo」
LinDoは、希少疾病や難病の治療現場に欧米と同様の薬剤選択が可能な環境を作るために、
革新的な新薬の種(シード)を育て市場に投入する企業(インキュベータ)です。

シード・インキュベータ「株式会社LinDo」
LinDoは、希少疾病や難病の治療現場に欧米と同様の薬剤選択が可能な環境を作るために、
革新的な新薬の種(シード)を育て市場に投入する企業(インキュベータ)です。
今日の医薬品市場は、治療満足度の低い疾病への治療薬開発が中心となり、世界の新薬は「希少疾病や難病、希少がんなど」の治療を目的とするものがその多くを占めています。 これらの新薬全体の7割以上は、既存の製薬企業ではなく、非常に高い創薬技術を持つエマージングバイオファーマ(EBP)から生まれています。
これらの新薬の中で大型製品化しそうな製品は、大手の製薬企業が導入し日本での臨床治験を実施して市場に投入されています。 残りの多数はEBPが資金調達をしながら臨床開発を行いますが、資金に余裕がないEBPが欧米での開発に加え日本でも臨床開発をすることは簡単ではありません。
特に小児科領域の開発では、世界の標準から大きく遅れているのが現状です。
その主な理由は下記の3つです。
一般的に資金調達規模が小さいEBPは、米欧での承認獲得が第一優先。日本での臨床開発を行う資金的な余裕がない。
市場構造、ポテンシャル、日本の承認制度への対応方法等、日本市場の理解がない。
日本国内での開発を行うための、企業ネットワーキングやパートナリングの課題が未解決。
このような理由が複合的に重なり、日本では多くの新薬が開発・承認されないドラッグロスという状況が社会問題になるとともに、新しい治療薬を求める患者さんや医療従事者とってその開発が大きな希望になっています。
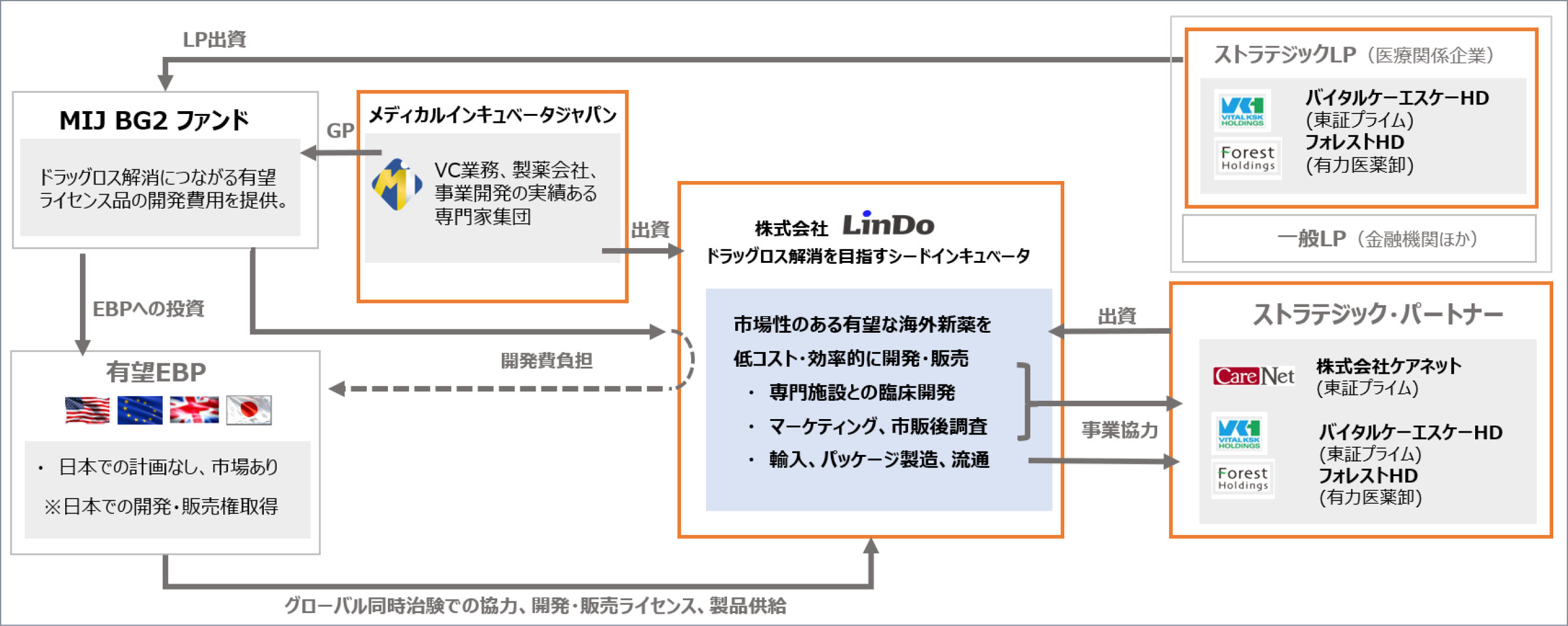
LinDoは、製薬企業での経験豊かなメンバーが株式会社メディカルインキュベータジャパン(MIJ)と協力することで生み出した開発スキームにより、革新的で有望な希少疾病や難病の新薬候補の国内承認に向けてシード・インキュベータとして臨床開発を推進いたします。

シーズ探索とライセンシングを加速する
MIJは、2018年から日本を含むグローバルの株式未公開EBPへのPE投資を行っているベンチャーキャピタルです。毎年の探索数は数百社に上り、有望シーズにコンタクトして評価しています。
MIJ BG2ファンドを通じて、より多くの有望シーズの探索活動を行っています。
LinDoは、独自のライセンシング力に加え、MIJの多彩なグローバルネットワークに由来する有望シーズ探索力、評価能力により有望シーズへのアクセスを強固なものにしています。
MIJの投資とLinDoの臨床開発でタッグを組むことにより、日本市場でEBPの新薬が開発に至らない課題をクリアし、国内市場に導入されるべき新規医薬品の臨床開発に全力で取り組みます。

精鋭かつ少数の臨床開発チームと
リーンな開発管理体制
EBPの有望な新薬の国内開発と承認取得のために、LinDoでは、国内の諸法令を遵守するガバナンス体制をとるとともに、製薬ビジネスの英知と豊富な経験を有する精鋭スタッフが導入から開発、マーケティングまで一貫して従事します。
また、開発治験からマーケティングやロジスティックスまで対応可能な提携企業とのパートナーネットワークを有しております。
臨床開発で重要なステップである市場探索、参加病院特定、治験医師特定やモニタリング等はパートナーの専門チームが参画しています。
開発チームのメンバーは海外EBPのシーズの国内開発で豊富な経験を有しており、開発戦略、薬事対応、開発管理、申請、承認まで海外EBPとの調整を図りながら実施します。
国内治験ではしばしば起こる患者エンロールメントの遅延対策として、提携企業が有する医師ネットワークを活用し、既存のCROでは実現できなかったプロトコールに適正な患者の迅速な特定と早期エンロールを実現いたします。
これらの新しい取り組みによりこれまでの開発企業と異なるリーンな経営スキームで、
希少疾患や難病治療薬の開発を進めてまいります。
OUR FOCUS
LinDoが導入、開発対象とする領域は、既存の治療薬では十分な効果や治療成果が達成できない「希少疾病」や「難病(国の指定難病など)」です。特に小児用の薬剤は、海外に比べ治療薬の選択肢と期待臨床効果の向上が大変期待されている領域です。
日本では希少疾患は「対象患者数が本邦において5万人未満であること」と定義されています。希少疾患はその多くが重篤、慢性かつ進行性で死亡率も高いため、患者さんやそのご家族、そしてまた社会にも深刻な影響を与えます。
「難病」とは、「難病の患者に対する医療等に関する法律(難病法)」により以下の3点を満たす疾患と定義されています。
欧米では、新規の成人用の適応症に係る製造販売承認を取得した場合には、当該適応症に関して小児に対する開発が法律により義務づけられており、小児の適切な薬物治療のための様々なエビデンスの構築が進んでいます。日本においては、小児医薬品の開発が法的に義務づけられていないことから、新薬に係る小児適応のエビデンス構築、更に承認が遅れる傾向にあります。
今日ではがん疾患は科学的な解明が進んでおり、患者さんごとの病態や経過を決定づけている遺伝子や蛋白をより詳細に分析して、個々のがんに直接作用する薬を投与して病気を治したり、病態を改善したりすることができるようになってきています。
このように患者さんのタイプにあわせて
最適な治療法を選択できる薬剤開発に焦点を当てます。